在國家自然科學(xué)基金(項目編號:81471538��,81525012)等資助下�����,山東大學(xué)基礎醫學(xué)院免疫學(xué)系高成江教授在抗病毒天然免疫研究領(lǐng)域取得重要進(jìn)展����。相關(guān)研究成果分別以“E3 ubiquitin ligase RNF128 promotes innate antiviral immunity through K63-linked ubiquitination of TBK1”(泛素連接酶RNF128通過(guò)K63位泛素化修飾TBK1促進(jìn)抗病毒反應)和“The ubiquitin E3 ligase TRIM31 promotes aggregation and activation of the signaling adaptor MAVS through Lys63-linked polyubiquitination”(泛素連接酶TRIM31通過(guò)K63位泛素化修飾促進(jìn)MAVS多聚體形成及活化)為題于2016年10月24日和12月19日在Nature Immunology上在線(xiàn)發(fā)表����。兩篇論文鏈接分別為:http://www.nature.com/ni/journal/vaop/ncurrent/full/ni.3588.htm和http://www.nature.com/ni/journal/vaop/ncurrent/full/ni.3641.html�����。
天然免疫應答是宿主在病原微生物感染后第一時(shí)間開(kāi)啟的重要防御措施�。宿主細胞在病毒感染后��,細胞內的模式識別受體(PRRs)識別病毒的病原相關(guān)分子模式(PAMPs)�����,活化復雜的天然免疫信號通路��,誘導I型干擾素���、促炎性細胞因子和其它一些下游抗病毒效應蛋白的表達�����,抑制病毒的復制�,清除感染機體的病毒����。但抗病毒天然免疫信號傳導的具體機制尚不清楚���。
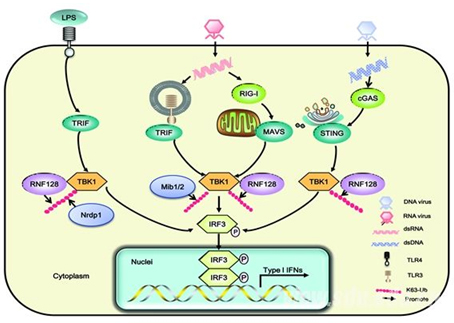
高成江教授課題組發(fā)現病毒感染可誘導泛素連接酶RNF128表達����;RNF128可通過(guò)對抗病毒信號通路中的關(guān)鍵激酶分子TBK1進(jìn)行K63位泛素化修飾����,進(jìn)而促進(jìn)TBK1激酶的活化和I型干擾素的分泌�,抑制病毒的復制�;體內實(shí)驗進(jìn)一步證實(shí)RNF128缺陷小鼠更易被RNA病毒(VSV)和DNA病毒(HSV-1)所感染����。這一研究成果拓展了RNF128在免疫反應調控中的功能�����,證實(shí)RNF128除了在適應性免疫中調控T細胞的功能之外��,也能調控RNA病毒和DNA病毒感染所介導的天然免疫信號通路�����。
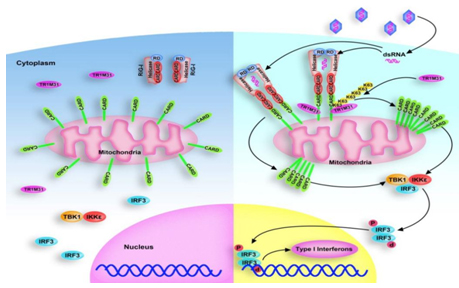
高成江教授課題組還發(fā)現RNA病毒感染可誘導泛素連接酶TRIM31募集到線(xiàn)粒體上����,并與線(xiàn)粒體上的接頭蛋白MAVS發(fā)生結合�����;TRIM31可以對MAVS上第10����、311和461位點(diǎn)的賴(lài)氨酸進(jìn)行K63位泛素化修飾����,進(jìn)而增強MAVS多聚體的形成和活化�����,促進(jìn)I型干擾素的分泌����,抑制病毒的復制���;體內實(shí)驗進(jìn)一步證實(shí)TRIM31缺陷小鼠更易被RNA病毒(VSV或SeV)所感染���,而對DNA病毒(HSV-1)的感染沒(méi)有影響���。
上述研究揭示了TRIM31調控RNA病毒介導的天然免疫信號通路的具體機制���,發(fā)現了TRIM31對MAVS的泛素化修飾是MAVS形成多聚化并活化下游信號通路的重要原因�,從而加深了對抗病毒天然免疫信號轉導調控機制的了解���。
圖1 E3泛素連接酶RNF128通過(guò)K63位泛素化修飾TBK1促進(jìn)抗病毒反應
圖2 泛素連接酶TRIM31通過(guò)K63位泛素化修飾促進(jìn)MAVS多聚化調控抗RNA病毒免疫反應