血清中 miRNA 抽提和實(shí)驗設計經(jīng)驗談
發(fā)布人:admin
瀏覽次數:1247
發(fā)布時(shí)間:2017-11-15
血液中 miRNA 的組成
血液中的 miRNA 到底是從何而來(lái)? 要往哪里 去? 這些 miRNA 的生理功能是什么? 以上這三個(gè)問(wèn)題是很多研究人員關(guān)心的問(wèn)題�����,事實(shí)上這些問(wèn) 題目前并沒(méi)有很明確的答案�����,我們知道 miRNA 是 內生性的短片段 RNA�,長(cháng)度約 17 到 23 核苷酸����, miRNA 可以藉由和信息 RNA(mRNA)結合誘導 信息 RNA 的降解���,進(jìn)而調控信息 RNA 和相對蛋 白的表現�。根據一些論文的揭示 1 和實(shí)驗室實(shí)際的 操作經(jīng)驗顯示���,正常人的血液中 miRNA 的含量是 極微量的��,但是在病人和檢體制備不佳的血液樣 本中卻可抽取到較大量的 miRNA�,根據這些觀(guān)察 現象的合理臆測����,病人血清中 miRNA 的來(lái)源���,很 有可能是因疾病造成的組織壞死或細胞凋亡破裂 而流泄出來(lái)的胞內 miRNA�����,經(jīng)由病人和正常人的 基因表現的芯片圖譜比較��,結果也傾向有或無(wú)表 現的差異����,而非特定 miRNA 表現量上升��;換言之�,我們觀(guān)察到相關(guān)的研究中��,病人的 miRNA 的表 現數目增加了�,而分析ㄧ些在正常人和病人中都 有表現的 miRNA�����,表現量的高����、低反而是其次的 表征��。因此數據分析的邏輯和方法也必須根據之 而調整�,但這些呈現異位性表現(ectopic expression)的 miRNA 并不影響其成為診斷疾病 和預后評估的標志的可能性����。已經(jīng)有一些研究指 出�����,這些不經(jīng)常表現在循環(huán)系統的 miRNA 可以成 為良好的疾病診斷標志����,如 miR-141 可以作為前 列腺癌的指標�����,miR-499 及 miR-208 和心肌梗塞(myocardial infraction)相關(guān)�����,miR-122 和藥物 造成的肝臟損傷有關(guān)����。
血清中 miRNA 抽提的挑戰
1 �、檢體的備制
血清(serum)好還是血漿(plasma)好?臨床上會(huì )根據檢驗的標的來(lái)選擇血液檢體的保存及制備方式����,血清和血漿都是來(lái)自血液檢體的成分����,但是根據制備的方式導致本質(zhì)上含有成分 有所不同�?��;谥苽涞姆椒芍?,血清是血液經(jīng) 由凝血反應后��,再經(jīng)由離心沈淀所得到的上清液����。而血漿則是血液在不凝血的狀況下��,經(jīng)由離心 去除血球后的液體�����。然而有文獻指出��,針對同一 個(gè)人的血清和血漿樣本抽提出來(lái)的 miRNA 的總量作比較��,很明顯的血清抽提的總量明顯比血漿抽 提的來(lái)得高����,這意謂著(zhù)制備的方法也會(huì )影響 miRNA 的抽提�,據推測這些 miRNA 可能是因為 凝血反應�,血小板或紅血球破裂后釋出的物質(zhì)����, 其中包含 miRNA�����,雖然大部分的實(shí)時(shí)定量聚合鏈 反應(q-PCR)驗證結果顯示���,血漿和血液的 miRNA 的表現圖譜并無(wú)顯著(zhù)差異�,然而這個(gè)已經(jīng) 存在的風(fēng)險���,可能在研究設計也是需要被考慮�����, 因此就理論上來(lái)說(shuō)���,是以血漿的檢體較適合作為 生物標記的找尋 ���。
2��、檢體的備制或保存不良是否可用?
已知血清或血漿中的 miRNA 的來(lái)源可能來(lái)自胞 內和胞外�����,尤其是血球(紅血球或白血球等)�����,因此 處理方式不當會(huì )造成檢體的污染��,改變 miRNA 的 組成和表現量���,造成研究結果的偏差���,尤其紅血 球的溶血現象影響甚劇�,不僅會(huì )造成紅血球 miRNA 污染而且紅血球中的大片段 mRNA 亦會(huì ) 造成定量的失準和因降解而形成實(shí)驗的偽陽(yáng)性產(chǎn)生(圖一)���。因此備制檢體時(shí)也要避免造成血球破裂 的動(dòng)作�,如用太細的針頭抽血�����、或檢體保存不當 造成溶血�����、或病人本身因疾病或治療造成的敗血 或溶血現象可能也是必須列入評估的考慮因素����。 此外抗凝血劑的使用必須避免使用含有肝素 heparin 的凝血管��,已知 heparin 會(huì )抑制反轉錄(reverse transcription)和聚合酶(polymerase)的反應���,如果檢體會(huì )進(jìn)行 q-PCR 的驗證一定要避 免����。同樣的血液檢體也含有抑制反轉錄和聚合酶 的成分�����,如果萃取時(shí)沒(méi)有移除干凈則會(huì )造成后續 實(shí)驗的失敗產(chǎn)生�����。
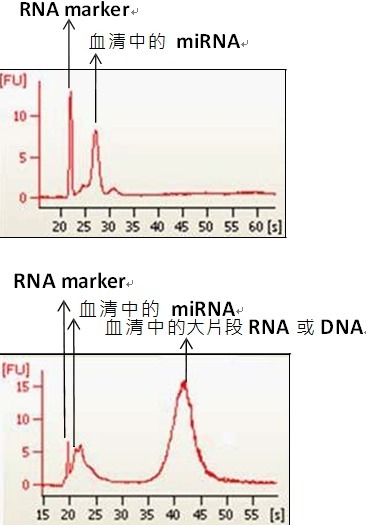
圖 一 .為血清抽提 miRNA 后����,經(jīng)由 Agilent Bioanalyzer2100 分析的 RNA 圖譜����,結果顯示提 取成功�,提出物中只有 miRNA 片段留存 �。圖二同圖一的實(shí)驗操作步驟 ���,結果顯示雖然提取是成功的 �����, 但是提出物中出現大片斷的可疑 DNA 或 RNA 片段 ����, 可能原始的檢體中有溶血的現象等干擾因素 ����。
miRNA 的定量
在抽提成功的情形下����,血清和血漿中僅含有少量的 RNA��,1 mL 血的抽提總量可能都在 ng 甚或 pg 等級�,這樣的結果意謂著(zhù)�����,運用現行的分亮度 計來(lái)測 OD 是不可行的(以 NaroDrop 為例:待測 濃度需高達 10ng/uL 才可信)���,而 Agilent bioana- lyzer 2100 也僅能做到定性的檢測���,沒(méi)法做精準的 定量����。檢視現行被使用的定量方法大概有:(一)在 等體積的血清或血液樣本中加入外控核酸 (spike)���,經(jīng)由抽提步驟后可經(jīng)由偵測外加的 spike 來(lái)校 正抽提的總量及效率��,作為校正檢體因抽提效率 或誤差造成的差異���。然而這只適用在檢體備制完 美及控制抽取技術(shù)無(wú)誤���,對于個(gè)體表現差異大和 檢體備制質(zhì)量不一的檢體��,并沒(méi)有辦法達到管控 的效用���;(二)經(jīng)過(guò)分亮度計測 OD 加以定量�,但是 除非抽提出的量達到分亮度計的可信水平�,否則 這些數值大概都是假訊號���,并不足以采信����;(三)使用內控基因的表現量來(lái)做為校正��。但根據研究 指出其實(shí)血清或血漿中 miRNA 的表現數量是有很 大的個(gè)體差異的���,以正常人當研究對象分析其表 現的 miRNA 數量���,最低 123 個(gè)���;最高有 296 個(gè) ����,可以有高達兩倍的差距��,再加上沒(méi)有適合的內 控基因 (internal control gene)可以做為控制組�,公認常用的內控基因 U6 或 SNORD RNAs 等���,在個(gè)體間的表現也是差異很大并不適用 1,2�����。因此 透過(guò) Agilent Bioanalyzer 2100 的結果進(jìn)行 miRNA 相對定量��;或從等體積血清抽提出 miRNA 再等比例取出進(jìn)行實(shí)驗����,似乎是較可信的做法��, 但是還是要取決于實(shí)驗的設計來(lái)決定�����。
結語(yǔ)
當我們理解了實(shí)驗的設計和預期可能的結果��, 避開(kāi)了可能的干擾因素��,做完芯片實(shí)驗拿到結果 后����,可能要先審視一下原始數據再決定要用那種 方法來(lái)分析數據���,例如��;假設控制組只有表現 200 個(gè) miRNA���,但是病人組表現 400 個(gè)����,那經(jīng)常 被使用的芯片校正方法如:median scaling 或 75th percentile���,可能就不適用
(本文轉載丁香通)




